Giới thiệu về siêu âm hội tụ cường độ cao US-HIIFU (Ultrasound High Intensity Focused Ultrasound): Tổng quan hệ thống về nguyên lý, thiết bị và ứng dụng lâm sàng
Tóm tắt
Siêu âm có thể thâm nhập sâu vào các mô và tương tác với mô người thông qua các cơ chế nhiệt và cơ học. Khả năng tập trung chùm siêu âm và năng lượng của nó vào các mục tiêu có kích thước milimét là một cột mốc quan trọng trong quá trình phát triển các ứng dụng điều trị của siêu âm hội tụ. Siêu âm hội tụ có thể được sử dụng như một kỹ thuật cắt bỏ nhiệt không xâm lấn để điều trị khối u và đang được phát triển như một lựa chọn thay thế cho các liệu pháp ung thư tiêu chuẩn. Siêu âm hội tụ cường độ cao hiện đã được sử dụng để điều trị lâm sàng nhiều loại khối u ác tính rắn, bao gồm các khối u ở tuyến tụy, gan, thận, xương, tuyến tiền liệt và vú, cũng như u xơ tử cung và sarcoma mô mềm. Chụp cộng hưởng từ và chụp siêu âm có thể được kết hợp với siêu âm hội tụ cường độ cao để cung cấp hình ảnh thời gian thực trong quá trình cắt bỏ. Siêu âm hội tụ có hướng dẫn cộng hưởng từ là một phương pháp điều trị không xâm lấn mới có thể đóng vai trò quan trọng như một phương pháp thay thế cho các thủ thuật phẫu thuật thần kinh mở để điều trị một số rối loạn não. Bài báo này tóm tắt các nguyên tắc cơ bản của HIFU và trình bày các ứng dụng, kết quả và biến chứng hiện tại sau khi điều trị. Các ứng dụng gần đây của siêu âm hội tụ trong điều trị khối u, đưa thuốc, tắc mạch, phẫu thuật cắt bỏ khối u, rối loạn vận động và các ứng dụng về mạch máu, ung thư và tâm thần được xem xét, cùng với các thách thức lâm sàng và các ứng dụng lâm sàng tiềm năng trong tương lai của HIFU.
1. Giới thiệu
Trong thực hành lâm sàng, nhiều loại năng lượng khác nhau đã được sử dụng để phá hủy nhiệt các mô, bao gồm dòng điện tần số vô tuyến, vi sóng, laser, nguồn dẫn nhiệt và siêu âm. Siêu âm mang lại một số lợi ích quan trọng, chẳng hạn như cho phép điều trị mô sâu hơn, cải thiện khả năng tập trung vào mô mục tiêu thông qua các bước sóng nhỏ của nó và kiểm soát chính xác hình dạng và vị trí lắng đọng năng lượng. Sử dụng siêu âm để làm nóng các mô là một trong những ứng dụng lâm sàng đầu tiên của nó. Lần đầu tiên nó được công nhận khi sóng siêu âm cường độ cao được sử dụng để điều hướng tàu ngầm trong Thế chiến II, được phát hiện có thể làm nóng và giết chết cá. Ngay từ những năm 1940, các nhà nghiên cứu đã cố gắng tập trung sóng siêu âm vào các mô cơ thể như một phương pháp thay thế cho các thủ thuật phá hủy.
Trong hai thập kỷ qua, những tiến bộ liên tục trong lĩnh vực hình ảnh, vật lý và kỹ thuật đã cho phép tập trung chính xác siêu âm vào các mục tiêu sâu hơn trong cơ thể. Siêu âm hội tụ cường độ cao (HIFU) là một trong những lĩnh vực nghiên cứu tích cực hơn trong số các phương pháp cắt bỏ không ion hóa; chẳng hạn như laser và vi sóng. Điều trị HIFU thường được hướng dẫn, đánh giá và theo dõi bằng hình ảnh cộng hưởng từ (MRI) hoặc hình ảnh siêu âm. Gần đây, siêu âm hội tụ cường độ cao (HIFU) và siêu âm hội tụ có hướng dẫn cộng hưởng từ (MRgFUS) đã chứng minh hiệu quả là phương thức cắt bỏ không xâm lấn đối với các mô mềm. Các phương pháp này hiện đã được sử dụng để điều trị cho hàng nghìn bệnh nhân trên toàn cầu, với MRgFUS được đề xuất như một phương pháp thay thế cho nhiều quy trình phẫu thuật.
Chìa khóa của phương pháp điều trị HIFU là năng lượng cung cấp đủ để tăng nhiệt độ mô lên mức độ gây độc tế bào rất nhanh để mạch máu mô không ảnh hưởng đến mức độ tiêu diệt tế bào. Đông tụ nhiệt bằng HIFU là mong muốn đối với phản ứng của tế bào với tình trạng viêm mãn tính và các dấu hiệu mô học của hoại tử mỡ ở mô mỡ bình thường xung quanh. Các mạch máu lớn dường như ít bị tổn thương do HIFU hơn so với các mô khối u. Điều này có thể là do năng lượng nhiệt từ thành mạch bị dòng máu tiêu tán, dẫn đến việc cắt bỏ khối u an toàn. Các biến chứng tử vong cũng có thể phát triển nếu bất kỳ mạch máu quan trọng nào bị tổn thương trong quá trình cắt bỏ. Điều này rất quan trọng khi phẫu thuật cắt bỏ khối u bị chống chỉ định và cắt bỏ bằng siêu âm có thể nguy hiểm do gần các mạch máu lớn.
Bài đánh giá này nhằm mục đích giới thiệu các nguyên lý vật lý của HIFU, bao gồm tác dụng làm nóng và tác dụng cơ học (tạo bọt) trong cơ thể, cùng với tổng quan ngắn gọn về các khía cạnh điều trị lâm sàng hiện tại của HIFU.
2. Nguyên lý đằng sau HIFU
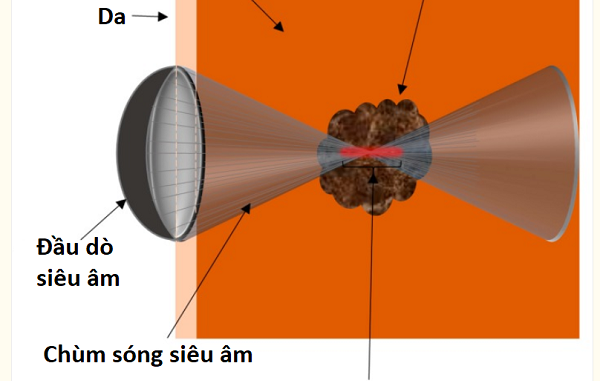
Chùm tia HIFU có thể đi qua da và mô bên trên mà không gây hại, và tập trung vào một vùng cục bộ có giới hạn kích thước trên khoảng 3–4 cm đường kính đối với khối u. cho thấy sơ đồ của đầu dò HIFU với chùm tia hội tụ trên khối u. HIFU tạo ra chùm tia siêu âm hội tụ đi qua da và mô bên trên để hoại tử một vùng cục bộ (khối u), có thể nằm sâu bên trong các mô. Khu vực bị ảnh hưởng tại điểm hội tụ của chùm tia dẫn đến hoại tử đông tụ tổn thương và được hiển thị màu đỏ trong. Khi khối u bị cắt bỏ, một ranh giới rất rõ nét giữa các tế bào chết và sống được tạo ra. Chiều rộng ranh giới giữa các tế bào bị phá vỡ hoàn toàn và mô bình thường không quá 50µm.
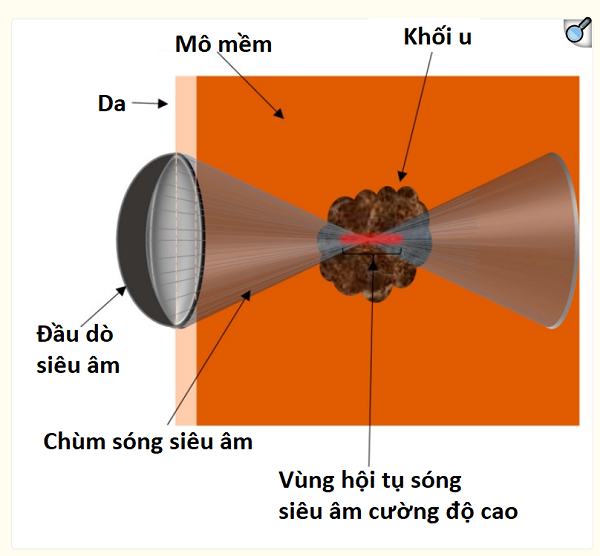
Sơ đồ tổng quan về siêu âm hội tụ cường độ cao để điều trị khối u.
Các nguyên tắc cơ bản đằng sau tổn thương mô từ HIFU là hoại tử nhiệt đông tụ mô do sự hấp thụ năng lượng siêu âm trong quá trình truyền mô (hiệu ứng nhiệt) và tổn thương do siêu âm gây ra. Nhiệt do HIFU tạo ra có thể dẫn đến nhiệt độ tăng nhanh ở mô tiếp xúc lên hơn 60 °C, dẫn đến chết tế bào ngay lập tức và không thể phục hồi ở hầu hết các mô khi kéo dài hơn 1 giây. Chùm siêu âm hội tụ cao tạo ra cường độ rất cao tại điểm hội tụ của chùm tia trong một thể tích nhỏ có đường kính khoảng 1 mm và chiều dài khoảng 10 mm, giúp giảm thiểu tổn thương tiềm ẩn cho các mô bên ngoài vùng hội tụ. Tổn thương mô do nhiệt độ cao phụ thuộc gần như tuyến tính vào thời gian tiếp xúc và theo cấp số nhân vào sự gia tăng nhiệt độ.
Một cơ chế khác liên quan đến quá trình phá hủy HIFU là hiệu ứng cơ học. Hiệu ứng cơ học này, bao gồm cả hiện tượng tạo lỗ rỗng, chỉ xảy ra với các xung âm cường độ cao. Hiện tượng tạo lỗ rỗng có thể tạo ra áp suất và nhiệt độ rất cao, ứng suất cắt cao và tạo ra các tia chất lỏng vi dòng có thể gây rỗ thành tế bào. Nếu môi trường chủ yếu là chất lỏng và có thể di chuyển tự do, thì chuyển động của chất lỏng có thể dẫn đến sản xuất dòng vi dòng, có thể gây ra chứng apoptosis tế bào. Nhân của các tế bào chết theo chương trình này tự hủy hoại với sự phân hủy axit deoxyribonucleic (DNA) bởi các endonuclease.
3. Hệ thống phân phối chùm tia siêu âm
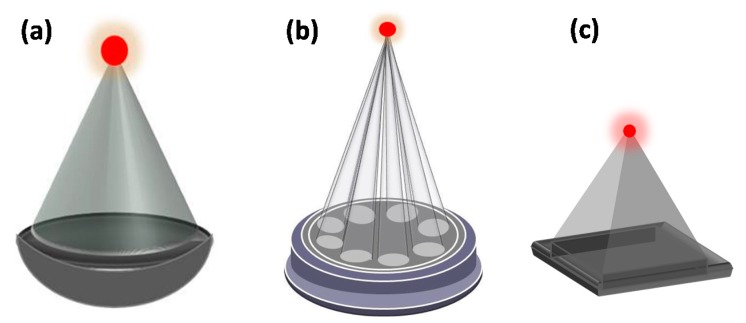
Nhìn chung, thiết bị HIFU bao gồm hai thành phần chính. Thành phần đầu tiên là đầu dò siêu âm áp điện được sử dụng để truyền chùm siêu âm trị liệu. Loại đầu dò phổ biến nhất được sử dụng là đầu dò hội tụ lõm có khẩu độ và tiêu cự cố định ( Hình 2 a). Các loại đầu dò khác bao gồm đầu dò mảng pha bao gồm nhiều đầu dò piston được sắp xếp trên bề mặt cụt của một bát hình cầu ( Hình 2 b) hoặc đầu dò phẳng/mảng pha được lắp đầy đủ ( Hình 2 c) (ví dụ: hệ thống HIFU Model-JC, Công ty Chongqing HAIFU™, Trùng Khánh, Trung Quốc). Chuyển động cơ học của đầu dò xác định vị trí của điểm hội tụ, với chức năng điều khiển điện tử của chùm siêu âm cho phép kiểm soát chính xác vị trí điểm hội tụ.
4. Phương thức hướng dẫn siêu âm
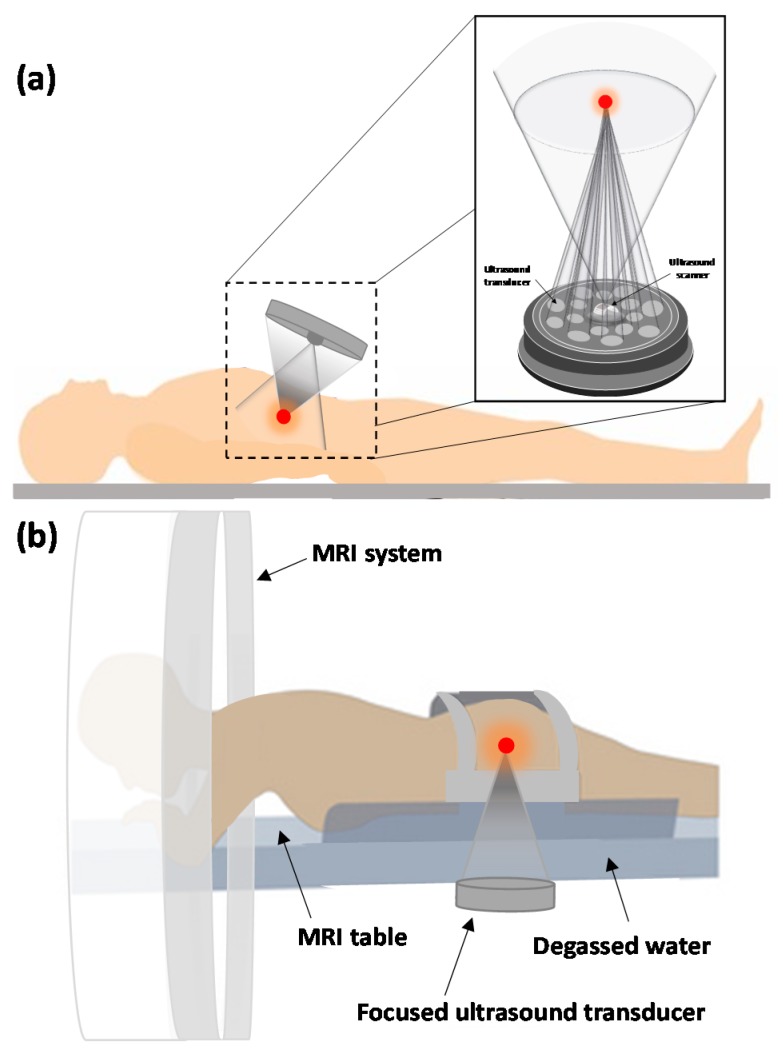
Thành phần chính thứ hai của HIFU là phương thức hình ảnh được sử dụng để hướng dẫn. Hình ảnh thời gian thực trong quá trình điều trị là điều cần thiết để đảm bảo tính an toàn và hiệu quả của quá trình điều trị. Các phương thức hình ảnh đã được sử dụng để theo dõi quá trình điều trị là siêu âm và Chụp cộng hưởng từ (MRI). Hình 3 a, b, tương ứng, cho thấy sơ đồ của các hệ thống siêu âm hội tụ được hướng dẫn bằng siêu âm và MRI (USgFUS và MRgFUS) điển hình được áp dụng cho mục tiêu qua da để điều trị bằng sóng xung kích ngoài cơ thể (ESWT) và HIFU.
4.1. Cộng hưởng từ
MRI với độ phân giải giải phẫu cao và độ nhạy để phát hiện khối u cung cấp khả năng lập kế hoạch chính xác cho mô cần nhắm mục tiêu và điều trị. Ngoài ra, nhiệt kế MR cho phép tính toán liều nhiệt và biểu diễn chồng lên hình ảnh giải phẫu của khu vực nhiệt độ đạt đến mức độ độc tế bào. Nó cung cấp khả năng kiểm soát vòng kín của quá trình lắng đọng năng lượng với độ chính xác nhiệt độ là 1 °C, độ phân giải không gian là 1 mm và độ phân giải thời gian là 1 giây trong quá trình điều trị HIFU. Trong vòng vài giây sau khi tiếp xúc với HIFU, MRI có thể cung cấp dữ liệu nhiệt độ và vượt trội hơn siêu âm đối với bệnh nhân béo phì vì nó không bị giới hạn bởi mô mỡ. Tuy nhiên, MRI đắt tiền, đòi hỏi nhiều nhân công và các tác động về thời gian và không gian của nó có thể dẫn đến việc đánh giá thấp nhiệt độ. MRgFUS tốt để đo nhiệt độ được tạo ra theo thời gian trong mô, nhưng không tốt để đo liều nhiệt gây tử vong cho mô.
4.2. Siêu âm
So với MRgFUS, hình ảnh siêu âm thuận tiện hơn và tương thích về mặt cơ học hơn, đồng thời cung cấp cùng một dạng năng lượng để hướng dẫn hình ảnh như được sử dụng cho liệu pháp. Nó mang lại lợi ích là xác minh cửa sổ âm thanh bằng siêu âm theo thời gian thực, điều đó có nghĩa là nếu vùng mục tiêu không được hình dung bằng hình ảnh siêu âm trước và trong quá trình điều trị HIFU, thì liệu pháp HIFU sẽ không có hiệu quả ở vùng cụ thể đó. Vùng mục tiêu bị cắt bỏ không được hình dung trên hình ảnh chế độ B tiêu chuẩn trừ khi các bong bóng khí được tạo ra trong vùng tiêu điểm xuất hiện dưới dạng các điểm tăng âm trong hình ảnh. USgFUS tốt cho việc định vị khối u mục tiêu trước khi thực hiện thủ thuật, nhưng không tốt cho việc đánh giá ranh giới điều trị trong khi thực hiện thủ thuật.
5. Khả năng tiếp cận của mô với siêu âm
Có ba cách khác nhau để áp dụng HIFU cho cơ thể con người dựa trên khả năng tiếp cận của cơ quan mục tiêu với siêu âm. Khi cơ quan dễ tiếp cận, chẳng hạn như thận, HIFU được áp dụng thông qua một cửa sổ âm thanh trên da bằng đầu dò bên ngoài hoặc ngoài cơ thể ( Hình 4 a). Tuy nhiên, trong các trường hợp khác như ung thư tuyến tiền liệt, có thể cần phải đưa đầu dò vào cơ thể (đầu dò qua trực tràng) ( Hình 4 b). Các đầu dò kẽ đang được phát triển để điều trị các khối u ống mật và thực quản và được đưa vào cơ thể qua miệng và đặt gần khối u ( Hình 4 c). Vì một thiết bị ngoài cơ thể được sử dụng để phân phối năng lượng tới trên một vùng da lớn nên thiết bị có khẩu độ rộng và tiêu cự dài để giảm cường độ âm thanh tại vị trí đi vào của vị trí sóng để tránh bỏng da. Thiết bị yêu cầu ghép năng lượng âm thanh với bề mặt da thông qua gel ghép hoặc bóng nước, với vị trí đi vào cửa sổ thích hợp trên da để chùm tia hội tụ lan truyền không bị gián đoạn bởi khí xen kẽ.
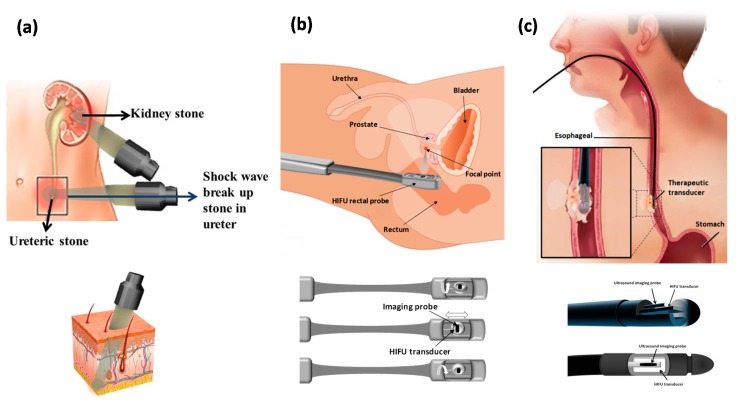
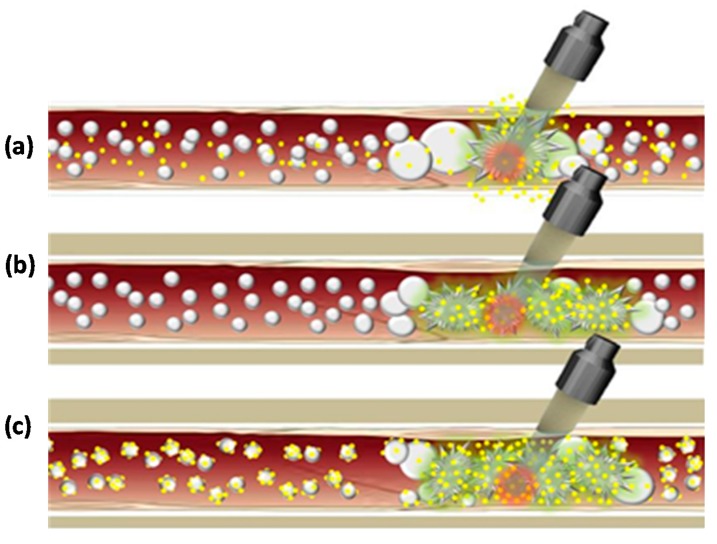
Đầu dò xuyên trực tràng và kẽ thường hoạt động ở tần số cao hơn và công suất thấp hơn để có thể áp dụng từ khoảng cách nhỏ hơn đến khu vực mục tiêu. Các thiết bị được phát triển để sử dụng xuyên trực tràng có đầu dò kết hợp liệu pháp và hình ảnh được tích hợp vào đầu dò đầu dò với điểm hội tụ cố định nhưng có thể điều chỉnh được, có thể di chuyển cơ học để điều trị thể tích mô lớn hơn ( Hình 4 b). Phá hủy tuyến tiền liệt được thực hiện bằng cách tạo ra các tổn thương liền kề cạnh nhau và công suất siêu âm được thay đổi để điều chỉnh chiều dài tổn thương. Đối với tuyến tiền liệt dày, các tổn thương sâu có thể đạt được bằng cách tạo các tổn thương thành hai lớp hoặc bằng cách sử dụng tiêu cự dài hơn. Đối với đầu dò kẽ, thay vì hội tụ đầu dò, người ta thường áp dụng đầu dò phẳng và đông tụ thể tích bằng cách xoay đầu dò [ 15 ]. Khi đầu dò đã vào đúng vị trí, có thể đạt được góc xoay 360° dưới sự hướng dẫn của huỳnh quang hoặc MRI, sau đó có thể định vị lại đầu dò và tạo ra một vòng phá hủy liền kề khác. Thiết bị này cũng có thể được sử dụng cho các khối u mật và thực quản hoặc cắt bỏ một phần thận không chảy máu [ 9 ]. Các thiết bị kẽ có thể bắt nguồn từ các thiết bị siêu âm qua da, nội soi ổ bụng hoặc dựa trên ống thông. Các thiết bị siêu âm dựa trên ống thông có thể được đặt bên trong hoặc liền kề với thể tích mục tiêu trực tiếp để điều trị và đông tụ một thể tích lớn của khu vực mục tiêu hoặc chúng có thể được sử dụng làm thiết bị tim nội mạch và nội mạch. Thời gian tiếp xúc của các thiết bị siêu âm dựa trên ống thông thường là 10–30 phút và quy trình này xâm lấn hơn so với HIFU bên ngoài; tuy nhiên, phương pháp này có khả năng định vị năng lượng tốt hơn. Các thiết bị siêu âm dựa trên ống thông đang được phát triển để sử dụng lâm sàng trong tương lai cho liệu pháp nhiệt đối với bệnh ung thư và các tình trạng lành tính ở tuyến tiền liệt, tử cung (u xơ), gan và xương.
Tùy thuộc vào kích thước hình học và các thông số âm thanh của đầu dò được áp dụng trong hệ thống HIFU, kích thước chùm tia của hệ thống HIFU −6 dB tại vùng tiêu điểm của nó thường rộng 1–3 mm và dài khoảng 10 mm. Tuy nhiên, khối u ung thư 1 cm có thể phát hiện và điều trị được bằng HIFU. Mối lo ngại về tính không đồng nhất của mô ở vùng bụng-chậu (như trong u xơ tử cung và khối u thận) hoặc sử dụng xuyên sọ có thể gây biến dạng chùm tia tiêu điểm hoặc giảm khả năng hội tụ ở các mô nằm sâu được giải quyết bằng cách áp dụng quy trình hiệu chỉnh pha trong hệ thống HIFU, giống như đã thực hiện với hệ thống hình ảnh siêu âm. Khi cần nhắm mục tiêu vào một thể tích lớn hơn để cắt bỏ, các đầu dò được áp dụng trong hệ thống HIFU sẽ được di chuyển cơ học hoặc điện tử theo các bước riêng biệt và bắn tại mỗi điểm cho đến khi kết quả là các vùng tiêu diệt tế bào hợp lưu.
Nhìn chung, tần số siêu âm điều trị phụ thuộc vào độ sâu điều trị cụ thể cho từng ứng dụng và tốc độ gia nhiệt mong muốn cần thiết cho quá trình điều trị. Tần số cao hơn có độ sâu thâm nhập thấp hơn trong khi tần số thấp hơn có độ sâu thâm nhập cao hơn. Tần số thấp tới 0,5 MHz đã được sử dụng cho các phương pháp điều trị sâu (như các ứng dụng xuyên sọ) hoặc các tình huống hấp thụ cao và cao tới 8 MHz cho các phương pháp điều trị nông (bao gồm các ứng dụng tuyến tiền liệt). Tần số gần 1 MHz đã được phát hiện là hữu ích nhất cho việc lắng đọng nhiệt.
6. Phân tích HIFU
6.1. Lợi ích
Nhiều lợi ích biện minh cho việc khám phá thêm về HIFU cho các ứng dụng lâm sàng bổ sung trong tương lai: Phá hủy bằng HIFU dẫn đến độc tính thấp hơn so với các kỹ thuật phá hủy khác; nó không xâm lấn và gây đau tối thiểu; nó là một thủ thuật chi phí thấp so với phẫu thuật; ít liên quan đến gây mê và phù hợp với những bệnh nhân có nguy cơ phẫu thuật cao; nó không để lại sẹo trên người bệnh nhân; nguy cơ nhiễm trùng thấp hơn; phục hồi nhanh hơn so với các kỹ thuật phẫu thuật truyền thống; bất kỳ chảy máu nào xảy ra trong quá trình thực hiện thường có thể được cầm máu bằng siêu âm; nó có khả năng lặp lại tuyệt vời vì không có giới hạn liều; không tiếp xúc với bức xạ ion hóa do được hướng dẫn bởi MRI hoặc siêu âm chẩn đoán trái ngược với chụp X-quang, cung cấp năng lượng chính xác đến một điểm mục tiêu trong mô mềm mà không ảnh hưởng đến tính toàn vẹn của da; chi phí bảo trì hệ thống thấp; nó gây ra rất ít tác dụng phụ đối với các mô bình thường xung quanh; sự thoải mái và an toàn của bệnh nhân được tối đa hóa; có thể hình dung thời gian thực không bị nhiễu trong quá trình thực hiện; và kỹ thuật này chính xác và dễ áp dụng.
6.2. Những hạn chế và biến chứng
Về mặt hạn chế, phương pháp điều trị HIFU nhạy cảm với chuyển động của bệnh nhân và nhiệt trường gần, và thời gian điều trị có thể kéo dài tới vài giờ. Khi sử dụng thiết bị ngoài cơ thể để phân phối năng lượng tới trên một vùng da rộng, thiết bị có khẩu độ rộng và tiêu cự dài để giảm cường độ âm thanh tại vị trí sóng nhằm tránh bỏng da. Tuy nhiên, đã có báo cáo về bỏng toàn bộ da nghiêm trọng sau tán sỏi ngoài cơ thể (ESWL) để điều trị sỏi thận hoặc bỏng cấp độ hai sau tán sỏi ngoài cơ thể. Ngoài ra, một số bệnh nhân gặp phải tác dụng phụ sau thủ thuật, chẳng hạn như đau, nôn và vết thương trên da. Đối với các mục tiêu nằm trong vú, bụng, não hoặc chân tay, thường sử dụng thiết bị HIFU ngoài cơ thể. Trong quá trình ứng dụng HIFU, có thể xảy ra tổn thương mô không mong muốn, bỏng không mong muốn và đau khi năng lượng siêu âm đáng kể được truyền đến một vùng mô tại chỗ. Ngoài ra, HIFU hiếm khi có thể gây co thắt mạch và xuất huyết khi hiện tượng tạo khoang đồng thời cũng xảy ra trong mô, bất lực và tiểu không tự chủ trong quá trình điều trị ung thư tuyến tiền liệt hoặc tạo ra lỗ rò nhĩ-thực quản trong quá trình điều trị rung nhĩ. Hơn nữa, hình thành lỗ rò và hoại tử xương sườn với gãy xương sườn muộn cũng được coi là những biến chứng nghiêm trọng có thể xảy ra sau khi điều trị ung thư gan và tuyến tụy.
7. Ứng dụng lâm sàng của HIFU
HIFU đã được sử dụng để điều trị nhiều loại khối u lành tính và ác tính rắn. HIFU có ưu điểm là hoàn toàn không xâm lấn, ngoài cơ thể và không ion hóa so với các phương pháp điều trị ung thư thông thường như hóa trị, xạ trị và phẫu thuật mở. Nó cũng được coi là kỹ thuật không xâm lấn duy nhất cho cả khối u rắn nguyên phát và điều trị bệnh di căn. Các tình trạng không phải khối u như phì đại tuyến tiền liệt cũng đã được điều trị bằng kỹ thuật HIFU. Ở đây chúng tôi thảo luận về các ứng dụng lâm sàng thường được sử dụng nhất của HIFU.
7.1. Khối u ác tính
7.1.1. Gan
Ung thư biểu mô tế bào gan (HHC), là một trong những loại ung thư gan phổ biến nhất và thường là một trong những loại ung thư gan khó điều trị nhất, đặc biệt là khi đa trung tâm. Điều này có thể làm cho kết quả cắt bỏ bằng phẫu thuật kém, với nguy cơ tái phát khối u cao. HIFU ngoài cơ thể đã cho phép cắt bỏ chọn lọc các nốt u gan phân tán. Wu và cộng sự, đã báo cáo điều trị cho 68 bệnh nhân gan ác tính bằng thiết bị điều trị khối u HIFU (Model JC, Trùng Khánh Haifu, Trùng Khánh, Trung Quốc) và quan sát thấy hoại tử đông tụ và mạch máu khối u bị tổn thương hoặc khối u biến mất hoàn toàn ở các khu vực mục tiêu . Ở 30 bệnh nhân được điều trị, cắt bỏ phẫu thuật chính thức sau HIFU đã dẫn đến cắt bỏ hoàn toàn khối u. Việc áp dụng thêm thiết bị HIFU trong một loạt 474 và 100 bệnh nhân cho thấy cải thiện triệu chứng (đau và lờ đờ) ở 87% bệnh nhân. Một nghiên cứu tại Vương quốc Anh (Bệnh viện Royal Marsden, London, Vương quốc Anh) đã báo cáo về phương pháp điều trị HIFU cho 69 bệnh nhân ung thư gan mà không cần gây tê tại chỗ hoặc an thần. HIFU cũng đã được sử dụng kết hợp với các phương pháp điều trị khác, chẳng hạn như kỹ thuật hóa chất tắc mạch động mạch qua ống thông (TACE), với kết quả sống sót đã được chứng minh là dài hơn so với chỉ sử dụng TACE. Nhìn chung, HIFU đã được chứng minh lâm sàng là có thể kéo dài thời gian sống và chất lượng cuộc sống ở bệnh nhân ung thư gan.
7.1.2. Ngực
HIFU có thể là một kỹ thuật không phẫu thuật hiệu quả để điều trị ung thư vú, đặc biệt là đối với những bệnh nhân có nguy cơ phẫu thuật cao và liệu pháp bảo tồn vú. Điều này là do tác dụng hoại tử khối u tại chỗ, giảm nhu cầu gây mê, thời gian phục hồi ngắn hơn, nguy cơ nhiễm trùng thấp hơn và không hình thành sẹo hoặc tổn hại tính toàn vẹn của da. HIFU đã được áp dụng để điều trị các loại ung thư vú khác nhau bao gồm ung thư biểu mô tiểu thùy xâm lấn, ung thư ống dẫn và ung thư biểu mô tuyến nhầy với tỷ lệ hoại tử đông tụ được báo cáo là 88-100% trong thể tích vú được điều trị. Một nghiên cứu theo dõi 5 năm chỉ ra tỷ lệ sống sót không có bệnh là 95%, tỷ lệ sống sót không tái phát là 89% và giảm 90% kích thước khối u ở những bệnh nhân được điều trị. Các nghiên cứu được báo cáo chủ yếu sử dụng thiết bị HIFU Model JC, thiết bị ExAblate 2000 (InSightec Ltd., Haifa, Israel) hoặc hệ thống HIFU tùy chỉnh ở tần số từ 1,5 đến 1,7 MHz. Sau khi điều trị bằng HIFU, phù vú tại chỗ, bỏng da tối thiểu đến rất ít và các tác dụng phụ nhỏ đã được báo cáo ở những bệnh nhân được điều trị. Không thể đánh giá tình trạng của các lề được điều trị do thiếu mẫu bệnh lý và nhu cầu đánh giá sau thủ thuật dựa trên hình ảnh thay vì bệnh lý học mô học thông thường là những hạn chế hiện tại. Tuy nhiên, phương pháp điều trị HIFU có thể gây ra sự phá hủy khối u và mất hoạt động lan truyền ở các khối u vú.
7.1.3. Ung thư tuyến tiền liệt
Các thử nghiệm điều trị ung thư tuyến tiền liệt sử dụng HIFU qua trực tràng đã cho thấy triển vọng trong thập kỷ qua tại hơn 100 địa điểm trên toàn thế giới (Châu Âu, Hoa Kỳ và Châu Á). Các nghiên cứu khác nhau đã báo cáo sự sụt giảm đáng kể kháng nguyên đặc hiệu tuyến tiền liệt (PSA) (xuống ≤0,2 ng/mL) và tỷ lệ sống sót đầy hứa hẹn ở bệnh nhân. Các nghiên cứu theo dõi 2–5 năm sau điều trị bằng HIFU cho thấy mức PSA thấp ổn định và tỷ lệ sinh thiết âm tính 60–90%. HIFU lâm sàng đã làm tăng tỷ lệ kiểm soát đối với ung thư tuyến tiền liệt được điều trị từ 50% (sau 8 tháng) trong những ngày đầu lên 90% trong các thử nghiệm gần đây hơn. Ngoài các phương pháp điều trị HIFU cục bộ, các phương pháp điều trị toàn tuyến cũng đã được sử dụng để cắt bỏ ung thư tuyến tiền liệt với kết quả là giảm 17 đến 35% tỷ lệ mắc khối u và giảm >90% thể tích khối u. Đối với ung thư tuyến tiền liệt tiến triển, liệu pháp tăng nhiệt siêu âm đã được thực hiện với các đầu dò siêu âm dạng kẽ/dựa trên ống thông kết hợp với liệu pháp xạ trị nội liều cao. Hai hệ thống điều trị có sẵn trên thị trường là Ablatherm® (EDAP-Technomed, Lyon, Pháp) và Sonablate®500 (Focus Surgery, Indianapolis, IN, Hoa Kỳ), sử dụng các đầu dò nội trực tràng chứa cả đầu dò điều trị và máy tạo ảnh siêu âm. Đầu dò được thiết kế để di chuyển theo chiều dọc và chiều quay 180° dọc theo và xung quanh trục đầu dò, cung cấp các tổn thương cục bộ liên tiếp và bao phủ hoàn toàn thể tích khối u ( Hình 4 b).
HIFU đã được chứng minh là một kỹ thuật an toàn với tác dụng phụ tối thiểu; tuy nhiên, một số biến chứng hiếm gặp đã được báo cáo bao gồm bí tiểu, nhiễm trùng, tiểu không tự chủ, hẹp niệu đạo, bất lực, rò trực tràng và đau mãn tính, có tỷ lệ xảy ra cao hơn ở các lần điều trị HIFU lặp lại so với một lần. Cắt bỏ niệu đạo tuyến tiền liệt trước khi điều trị HIFU đã được báo cáo là làm giảm tình trạng bí tiểu và giảm đáng kể thời gian cần đặt ống thông tiểu từ 40 xuống 7 ngày. Nhìn chung, điều trị ung thư tuyến tiền liệt bằng HIFU là một phương pháp đầy hứa hẹn và đặc biệt phù hợp với bệnh nhân béo phì, nam giới trên 65 tuổi hoặc những người không phải là ứng cử viên phẫu thuật.
7.1.4. Thận
Khi khối u thận có kích thước nhỏ, liệu pháp cắt bỏ HIFU không xâm lấn là phương pháp thay thế hấp dẫn so với cắt bỏ toàn bộ hoặc một phần thận. Một số ít nghiên cứu lâm sàng đã kiểm tra HIFU để cắt bỏ khối u ung thư thận đã báo cáo kết quả khả quan về tổn thương đồng nhất và không thể phục hồi đã được chứng minh bằng mô học ở các vùng được điều trị, hoại tử khối u 12 ngày sau điều trị ở 67% trong số 30 bệnh nhân, khối u co lại 6 tháng sau điều trị và giảm đau ngay lập tức ở 90% trong số 13 bệnh nhân. Các thiết bị được sử dụng để điều trị khối u thận bao gồm các thiết bị HIFU ngoài cơ thể (các thiết bị JC-Model, các thiết bị C-Model, một hệ thống đầu dò tập trung nguyên mẫu (Storz Medical, Tägerwilen, Thụy Sĩ) và một hệ thống HIFU nội soi (thiết bị Sonatherm1 (Misonix Inc, Farmingdale, NY, Hoa Kỳ). Các nghiên cứu đã báo cáo sử dụng HIFU ở tần số 1–4 MHz theo cả hướng dẫn không xâm lấn bằng đầu dò hình ảnh, xâm lấn thông qua đầu dò nội soi để tiếp xúc trực tiếp với khối u; các thủ thuật được thực hiện trong gây mê toàn thân hoặc gây tê ngoài màng cứng. Mặc dù HIFU được báo cáo là thành công trong điều trị khối u cực thận dưới, nhưng nó có thể không thành công đối với các khối u nằm ở cực thận trên do các xương sườn xen kẽ hấp thụ năng lượng của chùm tia.
7.1.5. Thực quản
Ung thư thực quản thường được xác định là ung thư biểu mô tế bào vảy trong lòng ống nhỏ cục bộ. Các phương pháp điều trị phổ biến bao gồm phẫu thuật và hóa trị liệu có hoặc không có xạ trị. Các phương pháp này có kết quả chung kém; với tỷ lệ sống sót sau 5 năm là 13–18%. Điều trị HIFU lâm sàng đối với khối u thực quản lần đầu tiên được báo cáo vào năm 2008 được thực hiện trên 4 bệnh nhân. Hoại tử khối u hoàn toàn đã được quan sát thấy ở một bệnh nhân, với đáp ứng khối u khách quan và cải thiện đáng kể tình trạng khó nuốt trong vòng 15 ngày ở tất cả các bệnh nhân. Hệ thống HIFU được sử dụng là đầu dò siêu âm kẽ, xoay trục cho phép điều trị khối lượng khối u theo hình quạt hoặc hình trụ, với đầu dò chuyên dụng để cung cấp chùm tia cường độ cao hình hộp song song ( Hình 4 c); cả hai đều là những đặc điểm đặc biệt phù hợp cho khối u thực quản. Đầu dò HIFU được đưa vào và di chuyển xuống thực quản bằng một trục dài linh hoạt, sau đó được đưa vào bên trong khối u để cắt bỏ ở tần số 10 MHz trong 10 giây; tổn thương đơn lẻ xảy ra ở khoảng cách 10 mm từ đầu dò. Nhìn chung, kết quả lâm sàng cho thấy hiệu quả tiềm tàng của liệu pháp HIFU nội nhãn đối với các khối u thực quản tại chỗ.
7.1.6. Tuyến tụy
Ung thư tuyến tụy thường được phát hiện muộn với tỷ lệ sống sót sau 5 năm là <5%. Trong khi phẫu thuật chỉ là một lựa chọn khả thi cho 20% bệnh nhân, HIFU đang nổi lên như một kỹ thuật điều trị tiềm năng. HIFU ngày càng được sử dụng đơn lẻ, kết hợp với hóa trị liệu (gemcitabine) hoặc như một liệu pháp bổ sung sau khi hóa trị liệu/xạ trị thất bại. Kết quả của các phương pháp điều trị HIFU đã cho thấy kết quả khả quan trong việc cắt bỏ khối u tuyến tụy với kích thước khối u giảm, cơn đau được giải quyết ở 80% bệnh nhân và tỷ lệ sống sót trung bình là 12,5% (dao động từ 8 tháng đến > 3 năm) trên các quần thể từ 30 đến 223 bệnh nhân. Các thiết bị HIFU ngoài cơ thể được sử dụng để điều trị tuyến tụy bao gồm hệ thống Model-JC được hướng dẫn bằng siêu âm (HAIFU, Trùng Khánh, Trung Quốc), HIFUNIT-9000 (Công ty TNHH Khoa học Công nghệ A&S Thượng Hải, Thượng Hải, Trung Quốc) và hệ thống FEP-BY (Tập đoàn Kỹ thuật Y sinh Yuande, Bắc Kinh, Trung Quốc). Điều trị HIFU đã được thực hiện mà không cần gây mê hoặc gây mê toàn thân hoặc gây tê vùng.
Các báo cáo về tác dụng phụ và biến chứng của phương pháp điều trị HIFU rất khác nhau. Trong khi một số nghiên cứu báo cáo không có biến chứng nào, những nghiên cứu khác lại báo cáo về hoại tử mỡ dưới da và đốt sống, đau, viêm tụy thoáng qua, giả nang và bỏng da ở 1,1–71% bệnh nhân. Một nghiên cứu đã quan sát thấy các biến chứng chính của lỗ rò khối u-tá tràng với đau bụng dữ dội, stent tá tràng và bỏng da độ ba ở 3–8,5% bệnh nhân và bỏng độ hai được báo cáo ở tất cả các bệnh nhân được điều trị. Nhìn chung, phương pháp điều trị chỉ bằng HIFU đã đạt được tỷ lệ giảm kích thước trung bình của khối u tụy là 50% và khi kết hợp với hóa trị liệu đã đạt được tỷ lệ đáp ứng tổng thể và một phần lần lượt là 43,6% và 14,6%.
7.1.7. Não
U nguyên bào thần kinh đệm là khối u ác tính phổ biến nhất của hệ thần kinh trung ương. Bệnh thường được điều trị bằng phẫu thuật cắt bỏ và hóa trị/xạ trị. Thách thức chính trong việc điều trị khối u não là sự lan tỏa của khối u khắp não và phác đồ hóa trị không thể vượt qua hàng rào máu não (BBB). HIFU, do khả năng truyền và tập trung năng lượng âm thanh qua hộp sọ nguyên vẹn và nhắm mục tiêu vào các vùng nhỏ, đã được nghiên cứu để giải quyết những thách thức này trong thập kỷ qua với tiến bộ lâm sàng chủ yếu trong việc cắt bỏ khối u. Ca phẫu thuật HIFU xuyên sọ đầu tiên trên 3 bệnh nhân u nguyên bào thần kinh đệm đã cho thấy tính khả thi của việc gây ra sự gia nhiệt cục bộ trong khối u não mục tiêu đến nhiệt độ tối đa tổng thể là 51 °C trong thời gian siêu âm 20 giây. Các bệnh nhân được điều trị ở mức công suất âm thanh là 800 W (một bệnh nhân) và 650 W (hai bệnh nhân), không đủ để đạt được ngưỡng nhiệt cục bộ đông tụ não và cắt bỏ là 55 °C. Tuy nhiên, dữ liệu ngoại suy cho thấy tính khả thi của việc gây phá hủy ở 1200 W (nhiệt độ đỉnh tiêu điểm 55 °C) mà không làm quá nhiệt hộp sọ . Hình 5 cho thấy mô hình mũ đầu dò MRgFUS ExAblate Neuro (InSightec, Haifa, Israel). Một số thách thức trong điều trị HIFU não bao gồm khó khăn trong việc lập bản đồ biến thiên nhiệt độ trong khối u và gây ra hiện tượng tạo hốc và xuất huyết các mạch máu mao mạch nhỏ ở mức siêu âm cường độ cao; Cường độ HIFU trên 4400 Wcm-2 trong 1 giây có thể ảnh hưởng nghiêm trọng đến mạch máu và gây chảy máu. HIFU trong liệu pháp điều hòa miễn dịch của khối u não cũng là một khái niệm điều trị hấp dẫn. Hiệu ứng tạo hốc cơ học của HIFU có thể gây ra phản ứng viêm và căng thẳng, cũng như những thay đổi miễn dịch trong khối u, khi kết hợp với liệu pháp miễn dịch có thể làm tăng phản ứng miễn dịch chống khối u của vật chủ và khắc phục tình trạng trốn tránh miễn dịch do u đa dạng nguyên bào thần kinh đệm gây ra. Nhìn chung, HIFU có vẻ là một kỹ thuật đầy hứa hẹn để loại bỏ khối u não, tuy nhiên vẫn cần phải thử nghiệm thêm.
7.1.8. Xương
Các báo cáo về HIFU được sử dụng để điều trị xương bao gồm các ứng dụng để phá hủy các vi mạch khối u và huyết khối để ngăn ngừa sự phát tán của các tế bào khối u máu, làm giảm đau của các khối u di cănvà điều trị các bệnh ác tính xương nguyên phát. Điều trị khối u ác tính bằng HIFU, dưới dạng phương pháp duy nhất hoặc kết hợp với hóa trị liệu, ở 10–44 bệnh nhân cho thấy tỷ lệ sống sót ≤87% sau 10 đến 38 tháng theo dõi, khối u thoái triển hoàn toàn ở ≤41,7% bệnh nhân, khối u co lại ≥50% thể tích hoặc hoại tử/xơ hóa từ trung bình đến một phần ở 8,3–33,3% bệnh nhân, bất hoạt các ổ khối u được chứng minh bằng hình ảnh, khối u tái phát hoặc tiến triển tại chỗ ở 1–3 bệnh nhân, tỷ lệ biến chứng là 18,2% và tử vong do di căn ở 2–5 bệnh nhân ung thư giai đoạn II và III. Điều trị HIFU đối với khối u xương nguyên phát cho thấy sự cắt bỏ hoàn toàn khối u, đáp ứng một phần đến trung bình và tỷ lệ tiến triển của bệnh nhân được điều trị. HIFU cũng đã giảm thành công cơn đau xương di căn tới 69,5–92% sau ba tháng điều trị mà không làm chậm trễ bất kỳ quá trình hóa trị sau phẫu thuật nào.
Các hệ thống HIFU được sử dụng trong thương mại trong các nghiên cứu được báo cáo là ExAblate 2000 (đầu dò mảng pha đa phần tử, tần số 1,0–1,5 MHz) và đơn vị Model JC (tiêu cự 13,5 cm và đầu dò 0,8 MHz). Trong quá trình điều trị, bệnh nhân có thể cần gây mê hoặc an thần. Đau và phù nhẹ tại chỗ, bỏng độ một và độ hai và bỏng độ ba cần can thiệp phẫu thuật thêm, tổn thương thần kinh ngoại biên, gãy xương, lỏng lẻo dây chằng, bong gân và nhiễm trùng thứ phát đã được báo cáo là các biến chứng của các trường hợp điều trị trong một số nghiên cứu khác nhau. Nhìn chung, HIFU đơn lẻ hoặc kết hợp với hóa trị liệu đã được chứng minh là một cách an toàn và rất hiệu quả để điều trị các khối u xương ác tính. Khả năng cứu vãn chi của HIFU (duy trì chức năng tốt ở các chi) khiến HIFU trở thành phương thức đầy hứa hẹn cho cả việc điều trị khối u và có lợi cho việc tái thông mạch và sửa chữa xương bất hoạt. Nó cũng có thể là một phương pháp không xâm lấn thay thế để giảm đau ở di căn xương với một số ưu điểm chính so với các phương thức điều trị không xâm lấn khác. Với kết quả tích cực của các nghiên cứu thí điểm ban đầu, cần phải nghiên cứu thêm.
7.2. Khối u lành tính và tình trạng bệnh
7.2.1. U xơ tử cung
U xơ tử cung hoặc u cơ trơn tử cung là khối u cơ trơn lành tính của tử cung, ống dẫn trứng, dây chằng rộng hoặc cổ tử cung, ảnh hưởng đến khoảng 25% phụ nữ. HIFU là phương pháp điều trị không xâm lấn có khả năng bảo tồn khả năng sinh sản và rút ngắn thời gian phục hồi. Kể từ khi được Cục Quản lý Thực phẩm và Dược phẩm (FDA) chấp thuận vào năm 2004, HIFU đã được sử dụng để điều trị cho hơn 2000 bệnh nhân trên toàn thế giới. Các thử nghiệm lâm sàng để điều trị khối u xơ lớn có u xơ tử cung có triệu chứng cho thấy điểm số mức độ nghiêm trọng của triệu chứng giảm 10 điểm ở 79% bệnh nhân được điều trị, với khối lượng u xơ giảm 31% sau 3 tháng, 13–33% sau 6 tháng và 9,3% sau 12 tháng. Những kết quả này dựa trên hướng dẫn của FDA về việc chỉ điều trị 10% thể tích u xơ, thời gian điều trị 180 phút và khoảng cách giữa thanh mạc và u xơ ít nhất là 15 mm. Nghiên cứu theo dõi 2,8 năm đối với 138 bệnh nhân được điều trị bằng HIFU đã báo cáo rằng có thêm 19 và 23% bệnh nhân (chủ yếu là bệnh nhân <43 tuổi) được điều trị lần lượt sau 36 và 48 tháng điều trị.
Các hệ thống có sẵn trên thị trường được sử dụng trong các nghiên cứu này là ExAblate 2000 (Insightec, Haifa, Israel), hệ thống điều trị Haifu JM (JM2.5C, Chongqing Haifu Technology Co., Ltd., Trùng Khánh, Trung Quốc), HIFUNIT 9000 (Shanghai Aishen Technology, Thượng Hải, Trung Quốc) và một thiết bị HIFU di động được thiết kế riêng (Storz Medical AG, Kreuzlingen, Thụy Sĩ). Điều trị HIFU cho u xơ tử cung lớn; ~4 cm theo độ dày, >45 cm3 thể tích, trong vòng chưa đầy 15 phút cũng đã được chứng minh trên các khối u đã cắt bỏ bằng cách sử dụng máy phá hủy siêu âm kẽ được đưa vào. Các thiết bị HIFU linh hoạt để hướng đến khối u xơ tử cung trong khi các cấu trúc nhạy cảm lân cận của ruột, da và dây thần kinh xương cùng có thể tránh được sự tiếp xúc với chùm tia âm thanh. Mặc dù kết quả lâm sàng của HIFU chủ yếu được ước tính dựa trên bảng câu hỏi, nhưng việc theo dõi lâu dài về việc giảm thể tích u xơ, giảm triệu chứng và hệ số khuếch tán biểu kiến tại vùng được điều trị; một phép đo về cường độ khuếch tán của các phân tử nước trong mô vẫn chưa được xác định. Nhìn chung, phương pháp cắt bỏ HIFU có vẻ là phương pháp điều trị hiệu quả và an toàn đối với u xơ có triệu chứng, đặc biệt là đối với những bệnh nhân không đáp ứng với phương pháp điều trị y tế.
7.2.2. Ngực
U xơ tuyến vú (FAD) là tổn thương lành tính ở vú thường được cắt bỏ bằng phẫu thuật. Ngoài phương pháp phẫu thuật cắt bỏ khối u thông thường hoặc phẫu thuật cắt bỏ vú bằng máy hút chân không, các kỹ thuật khác như HIFU, cắt bỏ bằng tia laser hoặc đông lạnh cũng đã được sử dụng. Một đánh giá toàn diện về các kỹ thuật này của Peek et al. chỉ ra rằng tất cả các kỹ thuật cắt bỏ này đều ít xâm lấn và có triển vọng trong điều trị FAD.
7.2.3. Rối loạn não
Khả năng tập trung và nhắm mục tiêu chùm tia siêu âm qua hộp sọ nguyên vẹn đến các khu vực nhỏ chỉ vài milimét là một cột mốc quan trọng trong việc cho phép cắt bỏ chính xác, tại chỗ mô não trong sọ để khắc phục một số rối loạn não. HIFU đã được nghiên cứu để điều trị các rối loạn não khác nhau bao gồm các rối loạn vận động (run vô căn; ET), bệnh Parkinson (PD) và bệnh Alzheimer (AD), trầm cảm/lo lắng và hội chứng đau-186, động kinh, tan huyết khối/xuất huyết não (188,189) và chuyển hướng dịch não tủy (CSF).
7.2.4. Rung vô căn
Rung vô căn (ET) là một rối loạn vận động ảnh hưởng đến các chi trên và cánh tay thuận. Khi nghiêm trọng, bệnh thường được điều trị bằng cách phẫu thuật phá vỡ nhân trung gian bụng của đồi thị; đạt được bằng cách đưa đầu dò xâm lấn và phẫu thuật cắt đồi thị bằng tần số vô tuyến (RF) ở nhiệt độ 75–80 °C hoặc bằng cách kích thích sâu vào não có thể gây nhiễm trùng và/hoặc xuất huyết. Các thử nghiệm điều trị HIFU gần đây trên bệnh nhân ET kháng trị liệu (4–15 bệnh nhân) cho thấy việc cắt bỏ nhiệt thành công mục tiêu đồi thị, cải thiện run ngay lập tức, giảm 75–89,4% run sau 1, 3, 6 và 12 tháng theo dõi, giảm 40% suy giảm chức năng thứ phát và tổn thương tiến triển dần dần sau 1 tuần và 1 đến 3 tháng theo dõi. Sau khi điều trị bằng HIFU, một số tác dụng phụ đã được quan sát thấy ở bệnh nhân bao gồm dị cảm (ở 25–27% bệnh nhân), bất thường thoáng qua về cảm giác, tiểu não, vận động, giọng nói, các vấn đề nhẹ về thăng bằng sau phẫu thuật và phát triển huyết khối tĩnh mạch sâu; tuy nhiên, không có tác dụng phụ nghiêm trọng nào được báo cáo.
7.2.5. Bệnh Parkinson
Bệnh Parkinson được đặc trưng bởi sự thoái hóa tiến triển của các tế bào thần kinh vận động. Sự gián đoạn của các nhân vận động chính có thể dẫn đến cải thiện đáng kể các triệu chứng vận động. HIFU có thể là một kỹ thuật cắt bỏ nhiệt không phẫu thuật tiềm năng để điều trị bệnh Parkinson thông qua việc nhắm mục tiêu sâu và đông tụ nhiệt của đường pallidothalamic. Nghiên cứu lâm sàng đầu tiên về ứng dụng này đã báo cáo việc điều trị cho 13 bệnh nhân mãn tính và kháng trị bằng cách áp dụng HIFU và tăng dần nhiệt độ mục tiêu lên đến 52–59 °C; 54 °C là cần thiết để hoại tử 100%). Kết quả cho thấy sự giảm đau ban đầu cao hơn; 60,9 so với 7,6%, thể tích đông tụ nhiệt lớn hơn; 172 so với 83 mm3 và giảm triệu chứng toàn cầu cao hơn sau 3 tháng theo dõi; 56,7 so với 22,5% ở bệnh nhân nhóm 2 so với nhóm 1, tương ứng. Kết quả cho thấy không có dấu hiệu tổn thương nhiệt trong các hình ảnh theo dõi, không có tác dụng phụ thần kinh liên quan đến thủ thuật hoặc thiết bị và báo cáo độ chính xác nhắm mục tiêu <1 mm chứng minh tính khả thi, tính an toàn và độ chính xác của phẫu thuật cắt bỏ u vùng đồi thị bằng HIFU.
7.2.6. Đau mãn tính và không ác tính
Hội chứng đau trung ương và ngoại biên là những tình trạng khó điều trị, đặc biệt là khi các loại thuốc dược lý thông thường không hiệu quả. Các thủ thuật phá hủy có thể được sử dụng để cắt bỏ các thành phần cảm giác hoặc tình cảm; não và tủy sống ở trung ương và dây thần kinh hoặc bó dây thần kinh ở các trường hợp đau mãn tính ở ngoại biên. HIFU đã được thử nghiệm để nhắm mục tiêu vào nhân bên trung tâm đồi thị sau ở những bệnh nhân bị bệnh thần kinh và kết quả cho thấy giảm đau từ 30 đến 100% trong vòng 48 giờ hoặc sau 3 và 12 tháng điều trị và kích thước tổn thương từ 3–5 mm. Các vấn đề an toàn tiềm ẩn được báo cáo bao gồm xuất huyết nhỏ hoặc biến chứng chảy máu ở vùng đồi thị vận động, có thể do nhiệt độ tạo lỗ rỗng hoặc siêu âm. Những biến chứng này có thể tránh được bằng cách phát hiện tạo lỗ rỗng và duy trì nhiệt độ tạo lỗ rỗng dưới 60 °C.
7.2.7. Bệnh lý lành tính tuyến tiền liệt
Điều trị bệnh lý lành tính tuyến tiền liệt bằng HIFU gây ra các vấn đề khác so với ung thư tuyến tiền liệt ác tính, vì ung thư tuyến tiền liệt thường là bệnh đa ổ. Phá hủy toàn bộ tuyến bằng HIFU thành công hơn ở các khối u lành tính. Tăng sản tuyến tiền liệt đã được điều trị thành công bằng HIFU bằng cách tạo ra các tổn thương không hồi phục ở mô tuyến tiền liệt mà không gây tổn thương thành trực tràng. Tuy nhiên, kết quả lâu dài sau liệu pháp HIFU qua trực tràng không khả quan.
7.2.8. Tuyến giáp
Các nốt tuyến giáp đã được điều trị bằng nhiều kỹ thuật khác nhau, trong đó phẫu thuật vẫn là phương pháp phổ biến và hiệu quả nhất. Điều này liên quan đến các rủi ro và biến chứng của hạ canxi máu, liệt dây thần kinh thanh quản tái phát tạm thời hoặc vĩnh viễn, chảy máu, nhiễm trùng sau phẫu thuật. Gần đây, hiệu quả của HIFU đã được chứng minh thành công trong việc cắt bỏ các nốt tuyến giáp rắn và phức tạp. Kết quả tích cực báo cáo sự co rút tối đa với mức giảm tới 50% thể tích nốt sau 12 tháng điều trị mà không có bất kỳ thay đổi nào về chức năng tuyến giáp. Không có biến chứng lớn hoặc tổn thương phụ đáng kể nào đối với các mô lân cận được báo cáo. Các biến chứng được báo cáo bao gồm đau trong quá trình thực hiện, đau lan về phía cổ, xương bả vai, cơ thang hoặc cánh tay, đỏ da nhẹ, phù dưới da, liệt dây thanh quản tạm thời và hội chứng Horner tất cả đều không nghiêm trọng và thường tự biến mất trong vòng vài ngày sau khi điều trị. Mặc dù HIFU được coi là một kỹ thuật hiệu quả để cắt bỏ các nốt tuyến giáp, nhưng vẫn cần nhiều nghiên cứu và dữ liệu hơn nữa.
7.2.9. Bộ não
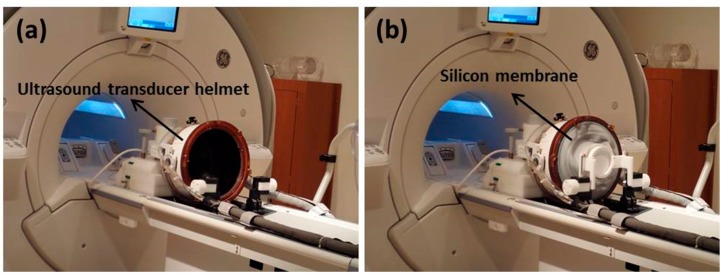
Thiết bị HIFU chính được sử dụng để đưa thuốc vào não người cho nhiều loại bệnh não khác nhau và cũng để phẫu thuật khối u não không cần dao mổ là ExAblate Neuro (InSightec, Haifa, Israel), bao gồm một mũ bảo hiểm hình cầu, mảng pha, đa phần tử (1000 đầu dò) được điều khiển bằng máy tính để bù méo mặt sóng ( Hình 6 ). Bệnh nhân thường được gây tê tại chỗ để thực hiện thủ thuật này [ 63 ]. Các phần sau đây thảo luận về các bệnh có thử nghiệm trên người đã báo cáo.
7.2.10. HIFU hướng dẫn hình ảnh
Các hệ thống hình ảnh chẩn đoán đã được sử dụng cùng với các thiết bị HIFU để cải thiện tính an toàn, định hướng liệu pháp và đánh giá chất lượng mạch máu hoặc cắt bỏ trong hoặc sau khi điều trị. Các phương pháp hình ảnh chính được báo cáo là FUS hướng dẫn bằng siêu âm (USgFUS) 868585 và FUS hướng dẫn bằng cộng hưởng từ (MRgFUS). Tùy thuộc vào ứng dụng cụ thể, hệ thống hình ảnh và đầu dò HIFU có thể được tích hợp hoặc tách biệt về mặt vật lý. Các hệ thống như ExAblate 2000 unite được tích hợp với MRI và cung cấp khả năng lập kế hoạch, lập bản đồ nhiệt và theo dõi theo thời gian thực. Hệ thống này chủ yếu được sử dụng cho các ứng dụng khối u não do mô đích có độ nhạy cao và nhu cầu điều trị hiệu quả và có độ chính xác cao. MRgUS được cho là vượt trội hơn USgFU về tính khả thi và hiệu quả, cũng như khả năng phát hiện các tổn thương sâu trong cơ thể và theo dõi nhiệt độ tăng cao trong mô được điều trị.
8. Các ứng dụng và kỹ thuật lâm sàng HIFU tiềm năng sắp tới
8.1. Tắc nghẽn mạch máu bằng HIFU
HIFU đang nổi lên như một kỹ thuật tiềm năng để làm tắc nghẽn mạch máu trong các bệnh hoặc tình trạng khác nhau như trong dị dạng động mạch tĩnh mạch để kiểm soát xuất huyết hoặc trong việc làm co khối u rắn bằng cách chặn/ngắt nguồn cung cấp máu của nó. Cần có thêm các nghiên cứu/dữ liệu để mô tả mối quan hệ giữa cường độ HIFU và đường kính mạch máu/vận tốc dòng chảy cần thiết để làm tắc nghẽn dòng chảy thành công và đánh giá các tác dụng phụ có thể xảy ra trong thời gian dài.
8.2. Phá vỡ hàng rào máu não
Khả năng phá vỡ cơ học của HIFU, được trung gian bởi hiện tượng tạo lỗ rỗng, khiến nó trở thành một kỹ thuật hấp dẫn để mở cục bộ hàng rào máu não (BBB); Sự phá vỡ BBB do bong bóng tạo lỗ rỗng có thể được thực hiện bằng cách tiếp xúc với HIFU rất cao, có thể gây vỡ hoặc tắc mạch máu hoặc hiệu quả hơn bằng cách sử dụng HIFU + các bong bóng siêu nhỏ được tiêm (chất cản quang siêu âm (US)). Phương pháp tiếp cận sau có thể tập trung năng lượng, trung gian các hiệu ứng sinh học và mở BBB trong vòng vài giây ở công suất HIFU <0,1% công suất đông tụ nhiệt cần thiết. Các nghiên cứu tiền lâm sàng đã chứng minh kết quả chứng minh khái niệm tạo ra sự phá vỡ BBB ngắn và cho phép đưa an toàn các tác nhân sinh học lớn và phức tạp đáng kể vào mô não. Lỗ mở được tạo ra thường lành lại trong vòng 6–24 giờ sau điều trị. Các thử nghiệm phá vỡ BBB HIFU để điều trị khối u não ở người đang được tiến hành tại Đại học Toronto.
8.3. Đột quỵ và tan huyết khối
Xuất huyết não hiện đang được điều trị bằng thuốc tiêu sợi huyết và phẫu thuật. HIFU có khả năng hóa lỏng máu để hút dễ dàng, có thể giúp giảm gánh nặng cục máu đông và hiệu ứng khối lượng để tránh phẫu thuật sọ não. Có thể đạt được hiệu quả tiêu cục máu đông thông qua hiệu ứng tạo khoang quán tính của HIFU công suất cao mà không cần tiêm bong bóng siêu nhỏ; >90% cục máu đông xuất huyết não hóa lỏng trong vài giây. Bonow và cộng sự gần đây đã đưa ra giả thuyết rằng HIFU xuyên sọ có thể có khả năng gây giãn mạch não điều trị và do đó, một ngày nào đó có thể được sử dụng để điều trị cho bệnh nhân xuất huyết dưới nhện. Hơn nữa, HIFU xuất hiện như một kỹ thuật tiềm năng để điều trị lâm sàng các rối loạn thiếu máu cục bộ não khác, co thắt mạch não và các bệnh mạch máu não khác.
8.4. Áp xe
Áp xe, đặc biệt là khi do vi khuẩn Staphylococcus aureus kháng methicillin (MRSA) gây ra có thể khó điều trị. Một nghiên cứu khả thi gần đây đã áp dụng HIFU, ở hai nhiệt độ cục bộ là 52 và 64 °C, trên các áp xe do MRSA gây ra ở chuột. Sau khi cắt bỏ bằng HIFU ở 64 °C, đã quan sát thấy sự giảm đáng kể về lượng vi khuẩn và kích thước bên ngoài của áp xe vào ngày thứ 4 và ngày thứ 10. Không có tác dụng phụ nào về việc tuyển dụng bạch cầu trung tính tại chỗ, phản ứng viêm toàn thân hoặc vết thương hở được báo cáo, điều này cho thấy triển vọng của kỹ thuật HIFU trong điều trị các bệnh nhiễm trùng liên quan đến MRSA tại chỗ. Vẫn cần các thử nghiệm mở rộng trên bệnh nhân.
8.5. Kỹ thuật siêu âm hội tụ mới nổi
Việc tích hợp siêu âm tập trung với các công nghệ điều trị hiện có khác nhau có thể cải thiện kết quả lâm sàng. Hình 7 cho thấy sơ đồ các cách khác nhau mà việc cung cấp thuốc có thể được tăng cường bằng cách sử dụng các kỹ thuật siêu âm-bong bóng siêu nhỏ. Ưu điểm của các kỹ thuật siêu âm-bong bóng siêu nhỏ so với các kỹ thuật khác như hệ thống cung cấp hạt nano hoặc liposome là khả năng kiểm soát bên ngoài chính xác
Tăng cường tính thấm của da bằng kỹ thuật này có thể thay thế việc sử dụng nhiều kim cho các loại thuốc như heparin và insulin hoặc cho phép khuếch tán các phân tử lớn (> 500 Da) qua lớp sừng. Liệu pháp gen trung gian bằng siêu âm tập trung cũng là một ứng dụng tiềm năng đang được nghiên cứu sâu rộng. Phẫu thuật cắt bỏ đồi thị bằng siêu âm tập trung được hướng dẫn bằng cộng hưởng từ để điều trị ET là một kỹ thuật phá hủy nhiệt xâm lấn tối thiểu mới nổi khác dành cho ET kháng trị về mặt y khoa. Phẫu thuật cắt bỏ đồi thị MRgFUS dẫn đến giảm run kéo dài đối với ET kháng trị về mặt y khoa trong thời gian dài. Phẫu thuật cắt đồi thị MRgFUS để làm giảm chứng run kháng thuốc đã được báo cáo là một kỹ thuật an toàn và hiệu quả ở những bệnh nhân mắc ET, PD và ET-PD (những bệnh nhân mắc ET phát triển PD nhiều năm sau đó. Ứng dụng HIFU để điều biến thần kinh đã trở thành một trong những lĩnh vực phát triển nhanh nhất trong khoa học thần kinh và là một lĩnh vực mới trong điều trị sức khỏe tâm thần. Tính hữu ích tiềm tàng của MRgFUS đối với các rối loạn ám ảnh cưỡng chế, trầm cảm, tâm thần phân liệt và chán ăn tâm thần.
9. Kết luận
Cả hiệu ứng nhiệt và không nhiệt (sục khí) đều đóng vai trò rất quan trọng trong mọi ứng dụng điều trị của siêu âm. Tác dụng phụ của hai cơ chế hoạt động này có thể gây hại về mặt sinh học và do đó được tránh trong các ứng dụng chẩn đoán của siêu âm nhưng có thể có lợi trong các ứng dụng điều trị. Khả năng tập trung chùm tia siêu âm vào một vùng nhỏ có kích thước vài milimét làm tăng cả hiệu ứng nhiệt và không nhiệt của siêu âm và dẫn đến sự phá hủy và hoại tử các tế bào tại điểm hội tụ được áp dụng. Điều này làm cho siêu âm trở thành một kỹ thuật phá hủy điều trị không xâm lấn tuyệt vời cho các mục tiêu nằm sâu trong cơ thể. Liệu pháp HIFU cung cấp một phương pháp tiếp cận ít xâm lấn hơn đối với liệu pháp điều trị ung thư giúp giảm thiểu sự khó chịu cho bệnh nhân và thời gian nằm viện. Các nghiên cứu ban đầu đã chứng minh HIFU nói chung là an toàn và có hiệu quả lâm sàng cao và có khả năng chấp nhận lâm sàng cao. Tuy nhiên, HIFU vẫn còn trong giai đoạn trứng nước và cần có thêm các nghiên cứu (đặc biệt là trong lĩnh vực ung thư và não) về các lợi ích y tế lâu dài, các cân nhắc về kỹ thuật và cung cấp phương pháp điều trị trước khi chuyển sang sử dụng rộng rãi hơn. Phạm vi ứng dụng của HIFU có thể mở rộng trong tương lai với hình ảnh được cải thiện. MRgFUS là một trong những phương pháp hướng dẫn hình ảnh thành công nhất. Tuy nhiên, cần có thêm các nghiên cứu theo dõi dài hạn hơn.
Nhóm tác giả: Zahra Izadifar, Zohreh Izadifar, Dean Chapman, Paul Babyn.
Link bài viết gốc: https://pmc.ncbi.nlm.nih.gov/articles/PMC7073974/

Bình luận